Las fuerzas intermoleculares son el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la polaridad que poseen las moléculas. Aunque son considerablemente más débiles que los enlaces ionicos covalentes y metalicos Las principales fuerzas intermoleculares son:
- El enlace de hidrógeno (antiguamente conocido como puente de hidrogeno)
-
- Dipolo - Dipolo.
- Dipolo - Dipolo inducido.
- Fuerzas de dispersión de London.
- Las atracciones moleculares son más débiles que los enlaces covalentes porque no son el resultado de compartir pares de electrones entre átomos; es decir, son interacciones no covalentes: fuerzas de atracción que no son enlaces iónicos y que son diferentes de los enlaces covalentes. Las interacciones no covalentes entre moléculas (fuerzas intermoleculares) explican el punto de fusión, el punto de ebullición y otras propiedades de las sustancias que no son iónicas. Las interacciones no covalentes entre diferentes partes de una molécula grande (fuerzas intramoleculares) mantienen las moléculas de importancia biológica con la forma exacta que requieren para desempeñar sus funciones. Por ejemplo, un gran número de interacciones no covalentes entre las cadenas de ADN establecen la estructura de doble hélice de esta molécula de gran tamaño. Sin embargo, las interacciones no covalentes individuales dentro del ADN son bastante débiles como para que sean vencidas en condiciones fisiológicas, lo cual hace posible la separación de las dos cadenas del ADN para copiarlos.




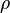 es la densidad del líquido,
es la densidad del líquido,  es la gravedad (9,8 m/s2) y
es la gravedad (9,8 m/s2) y 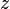 es la distancia del punto considerado a la superficie libre del líquido en reposo. En un fluido en movimiento la presión no necesariamente es isótropa, porque a la presión hidrostática se suma la presion hidrodinamica que depende de la velocidad del fluido en cada punto.
es la distancia del punto considerado a la superficie libre del líquido en reposo. En un fluido en movimiento la presión no necesariamente es isótropa, porque a la presión hidrostática se suma la presion hidrodinamica que depende de la velocidad del fluido en cada punto.










